Diferente tecnología de las baterías de plomo-ácido y litio
Uno de los conocimientos que se obtuvo en el siglo XIX con el desarrollo de la electrotecnia es la posibilidad de almacenar, si es el término correcto, energía eléctrica en un dispositivo mediante de una reacción electroquímica.
Breve historia de dos tecnologías
En 1859, Gaston Planté inventó la batería de plomo-ácido, la primera batería recargable de la historia. Varios tipos siguieron al modelo básico de Planté con una aplicación relativa, hasta que hubo dos aplicaciones que generalizaron su utilización, a partir del 1911 como fuente de energía eléctrica del motor de corriente continua en el arranque de los motores de combustión y del año 1916 en submarinos.
Pasó el tiempo y Stanley Whittingham, un joven químico británico, en 1972 desarrolló una batería con un cátodo de disulfuro de titanio y un electrolito líquido que utilizaba iones de litio. La batería de Whittingham no se parecía a ninguna de las anteriores. Funcionaba insertando iones en la red atómica de un material de electrodo anfitrión, un proceso llamado intercalación. El rendimiento de la batería también era inédito: era recargable y tenía un alto rendimiento energético. En 1985, Akira Yoshino desarrolló el primer prototipo basándose en las investigaciones anteriores de otros expertos durante la década de los 70. Posteriormente, un equipo de la empresa Sony construyó la primera batería comercial de ion de litio recargable en 1991.
Baterías constituidas por Plomo-Acido
Las baterías de plomo-ácido se construyen a partir de placas de plomo sumergidas en una solución de ácido sulfúrico y agua desmineralizada, siendo este el electrolito. El proceso de fabricación de estas baterías incluye los siguientes pasos:
Fabricación de las placas, se aplica una pasta de material activo a una rejilla, que sirve como soporte esquelético. Para las placas positivas se utiliza una pasta de dióxido de plomo. Para las placas negativas se utiliza un material llamado plomo esponjoso, basado en sulfatos de plomo en polvo.
Secado, las placas se dejan secar en un horno para que la pasta se endurezca y se fije a la rejilla. Se utilizan separadores porosos para separar las placas positivas de las negativas. La forma y la estructura de la rejilla son fundamentales para la conducción de la electricidad entre las placas de plomo.
Durante el proceso de carga inicial, el sulfato de plomo es reducido a plomo metal en las placas negativas, mientras que en las positivas se forma óxido de plomo (PbO2).
Durante la descarga se invierten los procesos de la carga. El óxido de plomo es reducido a sulfato de plomo mientras que el plomo elemental es oxidado para dar igualmente sulfato de plomo. Los electrones intercambiados se aprovechan en forma de corriente eléctrica por un circuito externo. Los procesos elementales que transcurren son los siguientes:
En la descarga baja la concentración del ácido sulfúrico porque se crea sulfato de plomo y aumenta la cantidad de agua liberada en la reacción. El proceso de reversibilidad no se puede repetir indefinidamente porque, cuando el sulfato de plomo forma cristales muy grandes, ya no responden bien a los procesos indicados, con lo que se pierde la característica esencial de la reversibilidad. La diferencia de potencial entre electrodos de cada celda individual, por su conformación electroquímica, es de 2 Volts. La carcasa o caja de la batería de plomo-ácido está hecha típicamente de plástico polipropileno resistente y sirve para contener las celdas dentro de los vasos, el electrolito y los componentes internos de conexión.A modo de ejemplo: Una batería de 12 Volts, posee seis vasos constituidos por un conjunto de celdas en paralelo cuya cantidad varía en función de los Ah deseados de la batería. A su vez los vasos están conectados en serie para obtener los 12 Volts. La densidad energética de las baterías de plomo-ácido es de 30 a 50 Wh/kg. Todos los componentes son reciclables.
Video de fabricación en: https://youtu.be/pDRGmlciwcI?si=eORhAgCLLs0V0S0o
Baterías constituidas por Litio
Las baterías de iones de litio (LIB) atraen un interés considerable gracias a sus altos valores de energía, densidad de potencia y vida útil de largo ciclo. Los LIB son células electroquímicas, como se dijo mas arriba, que convierten la energía química en energía eléctrica (y viceversa). Consisten en electrodos negativos y positivos (anodo y cátodo, respectivamente), ambos rodeados por el electrolito y separados por una membrana de que es un polímero permeable (separador). El electrolito está compuesto por: sales de litio, por ejemplo, hexafluorofosfato de litio (LiPF6) y el tetrafluoroborato de litio (LiBF4) son las más utilizadas. Como disolventes, el carbonato de etileno (EC), el carbonato de etilmetilo (EMC) y el carbonato de dimetilo (DMC) son algunos de los más comunes.
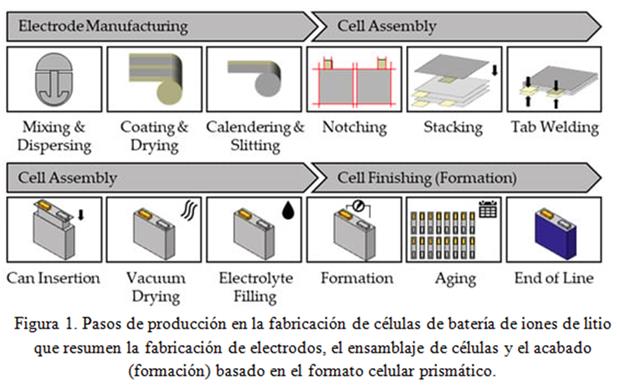
El procesamiento convencional de una batería de iones de litio consta de tres pasos: (1) fabricación de electrodos, (2) montaje de celda y (3) acabado celular (formación).
Aunque hay diferentes formatos celulares, como celdas prismáticas, cilíndricas y de bolsa, la fabricación de estas células es similar pero difiere en el paso de ensamblaje de la celda. A continuación se describe la producción de la serie de celdas prismáticas, y una visión esquemática para la fabricación de una celda de batería de iones de litio se da en la Figura 1, como referencia.
1.- La fabricación de electrodos comienza con la recepción de los materiales en una sala seca (medioambiente con humedad controlada, temperatura y presión). Los materiales en polvo se suministran en bolsas: bolsas grandes para el material activo y, en su mayoría, bolsas de papel para el aglutinante y el material conductor.
El material activo y un agente conductor se añaden directamente a la mezcladora de lodos (slurry) de electrodo, mientras que el polvo de aglutinante se alimenta primero a otra batidora para preparar la solución del aglutinante. Después de la mezcla seca del material activo y el agente conductor, la solución de aglutinante se añade para hacer un lodo para el recubrimiento de electrodos. Aunque se están estudiando diferentes alternativas para su reemplazo, NMP (N-Methyl-2-pyrrolidone) es el disolvente de cátodo más utilizado, mientras que el agua desionizada se utiliza para el ánodo.
Un electrodo consiste en un material electroactivo, así como en un material aglutinante, que permite la integridad estructural al tiempo que mejora la interconectividad dentro del electrodo, la adhesión al colector de corriente (lámina metálica) y la formación de la interfaz electrolítica sólida (SEI) durante los primeros ciclos de la batería de la celda.
En el proceso de producción de colectores de corriente es decir láminas de electrodos, el lodo de electrodos se recubre sobre la lámina metálica (colector de corriente) y se seca. La capa fabricada se denomina capa compuesta. Luego, la hoja se presiona con un rodillo de metal para aumentar la resistencia de la capa compuesta y mejorar la conductividad eléctrica (calandrado). Estos son algunos puntos clave a tener en cuenta al fabricar electrodos con respecto al rendimiento de la batería.
-Uniformidad de espesor al aplicar el lodo a los electrodos
-Uniformidad de propiedades eléctricas dentro de la superficie de la lámina del electrodo.
-Resistencia de contacto entre la capa compuesta y el colector de corriente
El colector de
corriente del ánodo es una lámina de cobre metálico y el colector de corriente del cátodo de
aluminio. El colector de corriente de electrodo positivo que se utiliza
habitualmente es una lámina de aluminio y el colector de corriente de electrodo
negativo es una lámina de cobre. Los potenciales de electrodo positivo y
negativo de las baterías de litio determinan la lámina de aluminio para el
electrodo positivo y la lámina de cobre para el electrodo negativo, no al
revés.
El potencial del electrodo positivo es alto, la lámina de cobre se oxida fácilmente a un potencial alto y el aluminio tiene un potencial de oxidación alto, y la superficie de la lámina de aluminio tiene una película de óxido densa, que también tiene un buen efecto protector interno sobre el aluminio. Ambos se utilizan como colectores de corriente porque tienen una buena conductividad eléctrica y una textura suave, y son relativamente comunes y economicos. Para garantizar la estabilidad de los colectores de corriente de la batería, se requiere que la pureza de ambos metales sea superior al 98 %.
2.- La conformación de las celdas se realiza de la siguiente manera, Durante el proceso de apilamiento, las láminas de electrodos separadas se apilan en un ciclo repetitivo de
ánodo separador, cátodo, separador, etc. Existe una amplia variedad de tecnologías de apilamiento, que suelen estar patentadas por fabricantes específicos. Una variante clásica del apilamiento es el llamado plegado en Z. Las láminas de ánodo y cátodo se insertan alternativamente desde la izquierda y la derecha en el separador plegado en forma de Z. El separador se utiliza en forma de cinta sin fin y se corta después del proceso de apilamiento.
3.- Para el sellado de las celda en forma de bolsa, las láminas colectoras de corriente (ánodo - cobre y cátodo - aluminio) se ponen en contacto primero con las lengüetas de la celda mediante un proceso de soldadura ultrasónica o láser. A continuación, la pila de celdas se coloca en la lámina de bolsa. Para ello, la lámina de bolsa se embute en un paso anterior del proceso. La celda en forma de bolsa se sella normalmente de forma hermética por tres lados mediante un proceso de sellado por impulso o por contacto. Un lado de la celda (a menudo la parte inferior de la celda) no se sella finalmente para poder llenar la celda con electrolito en el siguiente paso del proceso.
Después del proceso de envasado, se introduce el electrolito. Durante el llenado del electrolito, se debe distinguir entre los subprocesos de "llenado" y "humectación". El electrolito se introduce en la celda al vacío (llenado) con la ayuda de una aguja dosificadora de alta precisión. Mediante la aplicación de un perfil de presión en la celda (suministro de gas inerte y/o generación de vacío en funcionamiento alterno), se activa el efecto capilar en la celda (humectación). Finalmente, se sella al vacío.
Por último, el proceso de formación describe los primeros procesos de carga y descarga de la celda de la batería. Para la formación, las celdas se colocan en soportes especiales en bastidores de formación y se ponen en contacto mediante clavijas de contacto eléctrico. A continuación, las celdas se cargan o descargan según curvas de corriente y tensión definidas con precisión. Durante la formación, los iones de litio se incrustan en la estructura cristalina del grafito en el lado del ánodo. Aquí se forma la interfaz de electrolito sólido (SEI), que crea una capa de interfaz entre el electrolito y el electrodo.
Video de fabricación en: https://youtu.be/6vBH6zlrXuM?si=ElkLvfb20GDWLioU
Electroquímica
En una batería de iones de litio, el funcionamiento de la carga y descarga es el siguiente:
Cuando la batería se descarga, el ánodo libera iones de litio hacia el cátodo, lo que genera un flujo de electrones. En estado de carga los iones de litio son liberados por el cátodo y recibidos por el ánodo. Ejemplo de ecuación química de la batería de fosfato de hierro y litio:
El cátodo de una batería de fosfato de ion de litio está hecho de LiFePO4 y al descargarse, se transforma en FePO4. El ánodo está hecho de grafito.
Las reacciones para el ciclo de descarga se dan de la siguiente manera:
De acuerdo al material del cátodo, siendo el ánodo de grafito, la electroquímica de la celda determina la siguiente diferencia de potencial entre electrodos:
Cada batería individual es un conjunto de celdas en paralelo que determinan los Ah de la misma y la diferencia de potencial entre terminales depende de la electroquímica del cátodo, como se vio mas arriba.
La densidad energética promedio de las baterías de iones de litio es de entre 200 y 330 (Wh/kg).
Resumen
La batería de plomo-acido fue un hito dentro del desarrollo tecnológico/científico de la época. Por su simplicidad de elementos constitutivos y construcción, hoy en día se sigue utilizando en muchas aplicaciones. Más de 100 años después, la baterías de litio en sus diferentes versiones, son el producto de un conocimiento mucho mas avanzado insumiendo mayor cantidad/calidad de materiales y maquinaria para su constitución y una tecnología electroquímica acorde.
Ricardo Berizzo
Ingeniero Electricista 2025.-










No hay comentarios:
Publicar un comentario